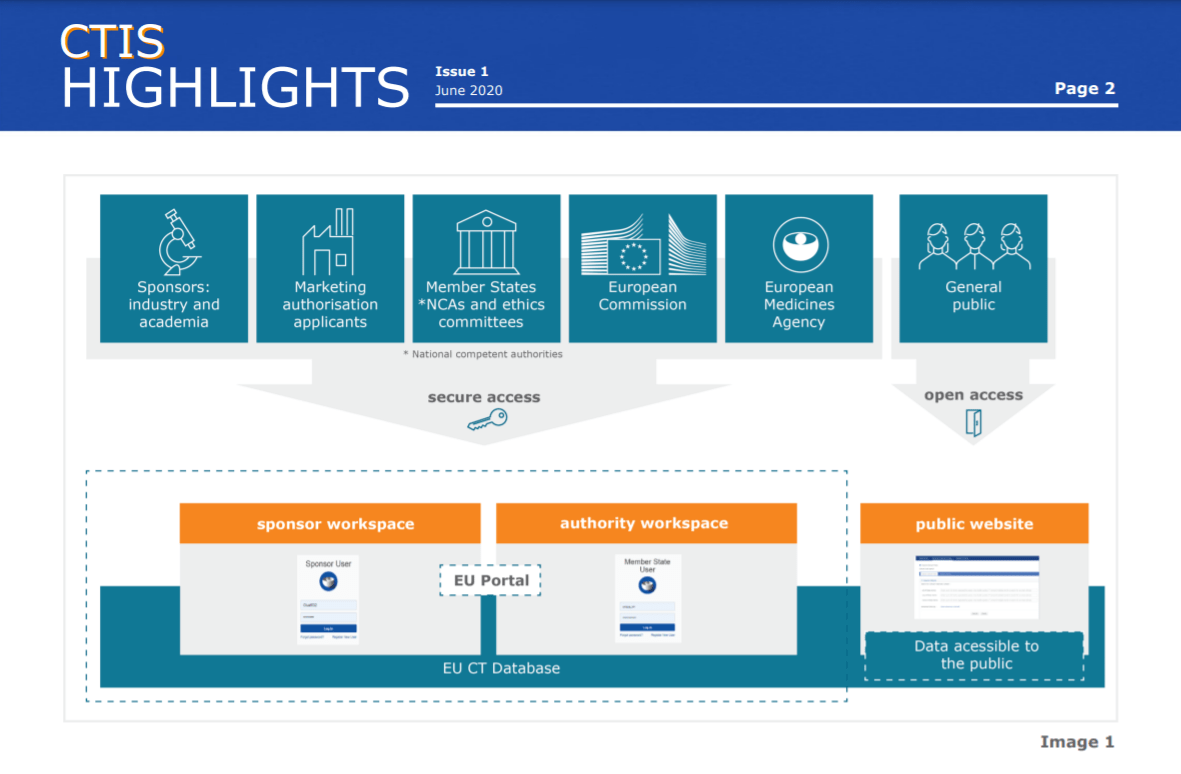
Πριν από λίγες ημέρες και συγκεκριμένα στις 31 Ιανουαρίου 2022 τέθηκε σε εφαρμογή ο Νέος Ευρωπαϊκός Κανονισμός 536/2014 για την κλινική έρευνα με παράλληλη έναρξη λειτουργίας του βασικού στοιχείου του που είναι το Πληροφοριακό Σύστημα Κλινικών Δοκιμών (Clinical Trial Information System – CTIS). To CTIS παρέχει ένα μοναδικό σημείο εισόδου για την υποβολή αίτησης, αξιολόγηση, έγκριση και επίβλεψη των κλινικών δοκιμών στην Ευρωπαϊκή Ένωση (ΕΕ) και τον Ευρωπαϊκό Οικονομικό Χώρο (ΕΟΧ). Στόχος του Νέου Ευρωπαϊκού Κανονισμού είναι η ενίσχυση της επίβλεψης και εναρμόνισης σε όλα τα Κράτη Μέλη, η μείωση της γραφειοκρατίας, η απλοποίηση των διαδικασιών, η αύξηση της ταχύτητας των εγκρίσεων, η διαφάνεια και η συντονισμένη αξιολόγηση των δεδομένων ασφαλείας των υπό μελέτη φαρμάκων.
Με τον τρόπο αυτό, η ΕΕ θα παραμείνει ανταγωνιστικός τόπος για την προσέλκυση και διεξαγωγή της κλινικής έρευνας.
Η Φαρμακευτική Βιομηχανία σε Ευρωπαϊκό (EFPIA), αλλά και τοπικό (ΣΦΕΕ) επίπεδο καλωσόρισε τον Κανονισμό, ο οποίος αποτελεί σημαντική τομή στην κλινική έρευνα και ανοίγει ένα νέο συναρπαστικό κεφάλαιο για τους ασθενείς και τις κλινικές δοκιμές στην Ευρώπη. Η εφαρμογή του Κανονισμού, σε συνδυασμό με την ολοένα και αυξανόμενη χρήση της ψηφιακής τεχνολογίας, αλλά και τη μελλοντική εφαρμογή των αποκεντρωμένων διαδικασιών για τις κλινικές δοκιμές (Decentralized Clinical Trials – DCTs) αποτελούν τους παράγοντες που καθορίζουν την “επόμενη ημέρα” για την κλινική έρευνα.
Ο Κανονισμός μπορεί να καταστεί καταλύτης για την κλινική έρευνα στην ΕΕ και την Ελλάδα εάν η εφαρμογή του συνδυαστεί με αλλαγή νοοτροπίας σε όλο το οικοσύστημα τής έρευνας. Το να καταστεί η χώρα μας ελκυστικός τόπος για τη διεξαγωγή κλινικών δοκιμών σημαίνει μια μεγάλη ευκαιρία για την Ελλάδα και, παράλληλα, μια σημαντική δυνατότητα για τους ασθενείς να αποκτήσουν πρόσβαση στις πλέον σύγχρονες θεραπευτικές επιλογές, το νωρίτερο δυνατό.
Ωστόσο, στη χώρα μας εξακολουθούν να υφίστανται ανεπίλυτα διαδικαστικά θέματα, κυρίως σε επίπεδο Νοσοκομείων, τα οποία δημιουργούν αναχώματα στη διεξαγωγή των κλινικών δοκιμών. Η κλινική έρευνα είναι μια παγκόσμια και εξαιρετικά ανταγωνιστική διαδικασία, η οποία καθορίζεται από συγκεκριμένους, πολύ αυστηρούς παράγοντες (ταχύτητα, υψηλή ποιότητα, πρότυπες διαδικασίες λειτουργίας). Εάν θέλουμε η Ελλάδα να προσελκύσει περισσότερες κλινικές δοκιμές και μεγαλύτερη επένδυση από τις διεθνείς φαρμακευτικές επιχειρήσεις, είναι απαραίτητο να αυξήσει τον ανταγωνιστικό χαρακτήρα της.
Με βάση μελέτη της PwC με θέμα «Πώς θα προσελκύσει κλινικές μελέτες η Ελλάδα», η οποία διεξήχθη για λογαριασμό του ΣΦΕΕ και παρουσιάστηκε πρόσφατα, τα κριτήρια ανταγωνιστικότητας, δηλαδή τα κριτήρια, με τα οποία επιλέγονται οι χώρες για τη διεξαγωγή μιας κλινικής δοκιμής είναι κατά σειρά σπουδαιότητας τα ακόλουθα:
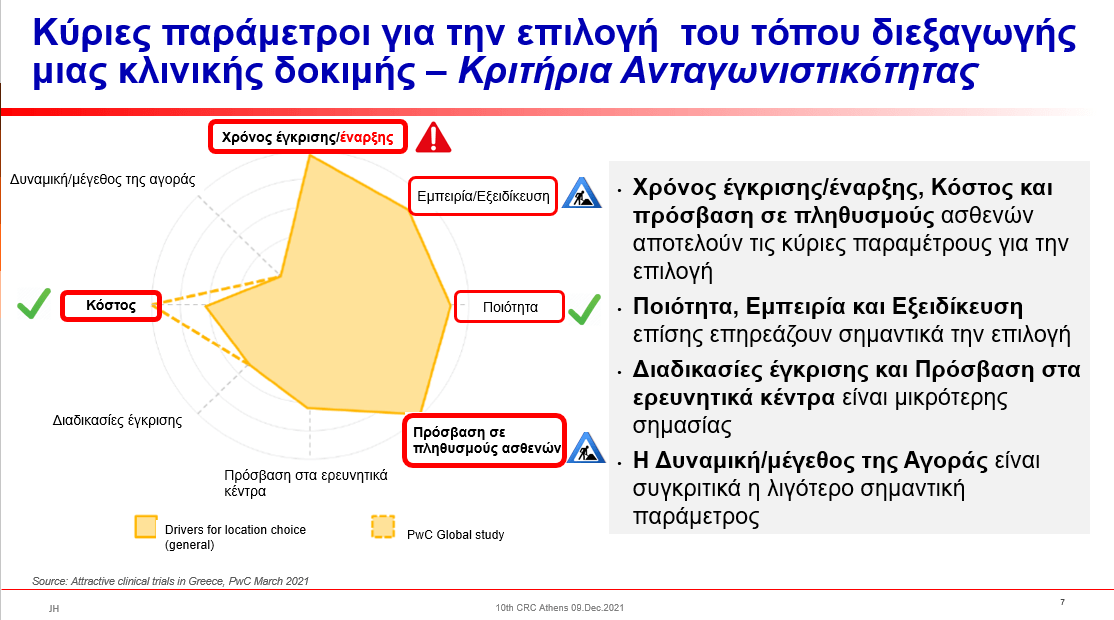
- Ο Χρόνος έγκρισης και έναρξης μια κλινικής δοκιμής. Τόσο ο Εθνικός Οργανισμός Φαρμάκων (ΕΟΦ), όσο και η Εθνική Επιτροπή Δεοντολογίας για τις κλινικές δοκιμές (ΕΕΔ) λειτουργούν εύρυθμα, γρήγορα και υποστηρικτικά, δίνοντας ανταγωνιστικό πλεονέκτημα στη χώρα μας στο πεδίο της έγκρισης των κλινικών δοκιμών. Το αντίθετο, ωστόσο, συμβαίνει με τα Νοσοκομεία και τους Φορείς Οικονομικής Διαχείρισης (ΕΛΚΕ/ΕΛΚΕΑ), όπου τα χρονίζοντα και ανεπίλυτα γραφειοκρατικά προβλήματα καθυστερούν σημαντικά την έναρξη των κλινικών δοκιμών. Αποτελεί άμεση και επιτακτική ανάγκη η επίλυση αυτών των θεμάτων, δεδομένου ότι με την εφαρμογή του Νέου Ευρωπαϊκού Κανονισμού και την προβλεπόμενη κεντρική διαδικασία υποβολής, αξιολόγησης και έγκρισης μια δοκιμής στο CTIS, η έναρξη της δοκιμής στο Νοσοκομείο θα αναδειχθεί σε κύριο παράγοντα ανταγωνιστικότητας για τις συμμετέχουσες χώρες.
- H πρόσβαση σε πληθυσμούς ασθενών. Στη σημερινή εποχή όπου βασική και καθημερινή πηγή πληροφόρησης για όλους μας αποτελεί το διαδίκτυο, δεν μπορεί να μην υπάρχει διαδικτυακός τόπος ενημέρωσης/πληροφόρησης για όποιον ενδιαφέρεται να συμμετάσχει σε μια κλινική δοκιμή που αφορά στην πάθησή του. Αυτή η δυνατότητα πληροφόρησης του κοινού θα διευκολύνει σημαντικά τη συμμετοχή ασθενών σε κλινικές δοκιμές. Η ανάπτυξη του Εθνικού Μητρώου Βιοιατρικής Έρευνας (Ε.Μη.Β.Ε.), με περιεχόμενο που θα αφορά σε πληροφορίες για την κλινική έρευνα σε τοπικό επίπεδο, είναι όχι μόνο χρήσιμη, αλλά και απαραίτητη.
- Κόστος. Σε αυτό το κριτήριο, η χώρα μας βρίσκεται σε καλό επίπεδο, κάπου στη μέση, συγκρινόμενη με τις υπόλοιπες χώρες που διεξάγουν κλινικές δοκιμές. Τα διάφορα οικονομικά κίνητρα, όπως για παράδειγμα ο συμψηφισμός της αυτόματης επιστροφής clawback με ποσοστά επί των δαπανών έρευνας και ανάπτυξης και των δαπανών επενδυτικών σχεδίων ανάπτυξης προϊόντων ή υπηρεσιών ή γραμμών παραγωγής το λεγόμενο “επενδυτικό clawback”, ή η φορολογική υπερέκπτωση των δαπανών έρευνας & ανάπτυξης, λειτουργούν σημαντικά στην κατεύθυνση της μείωση του κόστους. Είναι όμως σημαντικό τα παρεχόμενα από την Πολιτεία κίνητρα να παραμένουν τουλάχιστον σταθερά στην πορεία του χρόνου, εάν όχι να βελτιώνονται. Η νέα ΚΥΑ Γ.Π. οικ. 80277/23.12.2021 (Β’ 6247) «Διαδικασία, όροι και προϋποθέσεις συμψηφισμού αυτόματης επιστροφής clawback με ποσοστά επί των δαπανών έρευνας και ανάπτυξης και των δαπανών επενδυτικών σχεδίων ανάπτυξης προϊόντων ή υπηρεσιών ή γραμμών παραγωγής», η οποία προβλέπει την ένταξη του εν λόγω κινήτρου στο Ταμείο Ανάκαμψης, διαφαίνεται, δυστυχώς, σαφώς πιο σύνθετη και, ταυτόχρονα, πιο προβληματική για επενδύσεις σε Έρευνα & Ανάπτυξη.
- Ποιότητα. Και σε αυτό το κριτήριο η χώρα μας είναι σε πολύ καλό επίπεδο, λαμβάνοντας υπόψη ότι τόσο σε τοπικές, όσο και σε διεθνείς επιθεωρήσεις (Inspections) από τις αρμόδιες Αρχές (ΕΟΦ, ΕΜΑ, FDA) τα αποτελέσματα είναι πραγματικά πολύ καλά.
- Εμπειρία και Εξειδίκευση. Η άρτια γνώση και εκπαίδευση όλων των εμπλεκομένων στην κλινική έρευνα είναι σημαντικός παράγοντας για την ορθή διεξαγωγή της κλινικής έρευνας. Το κριτήριο αυτό πληρείται από τους ερευνητές και τις ερευνητικές ομάδες των ερευνητικών κέντρων, όχι όμως και από τις Διοικήσεις/Διοικητικές Υπηρεσίες των Νοσοκομείων. Είναι σημαντικό να σχεδιαστεί και να υλοποιηθεί από τις αρμόδιες Αρχές σχετικό εκπαιδευτικό πρόγραμμα, εάν όχι σε όλα, τουλάχιστον στα Νοσοκομεία με έντονη δραστηριότητα στη διεξαγωγή κλινικών δοκιμών. Η εκπαιδευτική δραστηριότητα, σε συνδυασμό με την ένταξη της κλινικής έρευνας στη συνολική αξιολόγηση του έργου των Διοικητών των Νοσοκομείων, θα λειτουργήσουν στην κατεύθυνση της δημιουργίας ερευνητικής κουλτούρας που σήμερα απουσιάζει. Η οργάνωση της απαραίτητης υποδομής για τη διεξαγωγή κλινικών δοκιμών στα Νοσοκομεία είναι θέμα που θα ενισχύσει τον ανταγωνιστικό χαρακτήρα της χώρας μας.
Η μελέτη της PWC κατέγραψε τα δομικά προβλήματα στη διεξαγωγή των κλινικών δοκιμών στην Ελλάδα και ανέλυσε μια σειρά προτάσεων, με βάση τις επιτυχημένες πρακτικές που εφαρμόστηκαν σε άλλες Ευρωπαϊκές χώρες και είχαν ως αποτέλεσμα την ενίσχυση του ανταγωνιστικού τους χαρακτήρα και την αύξηση του αριθμού των κλινικών δοκιμών σε αυτές.
Με βάση την εν λόγω μελέτη, οι βασικές προτάσεις του ΣΦΕΕ είναι:
- Ίδρυση γραφείου κλινικής έρευνας στα Νοσοκομεία με τη μεγαλύτερη δραστηριότητα σε κλινικές δοκιμές (~10 έως15) που θα λειτουργούν ως one-stop-shop και, παράλληλα, ορισμός επιτελικής δομής – προσώπου/υπευθύνου στο Υπουργείο Υγείας, με αντικείμενο την Κλινική Έρευνα (συντονισμός, παρακολούθηση, δείκτες παραγωγικότητας, επίλυση προβλημάτων, κλπ.). Το μοντέλο αυτό, με βάση τη μελέτη της PwC, υφίσταται και λειτουργεί με επιτυχία σε όλες τις χώρες που επιδιώκουν προσέλκυση κλινικών δοκιμών.
- Προώθηση περαιτέρω νομοθετικών πράξεων και ρυθμίσεων με άμεση την έκδοση Υπουργικής Απόφασης αναφορικά με τη διαδικασία κατάθεσης φακέλων κλινικών μελετών στα νοσοκομεία, τα σχετικά πρότυπα συμβάσεων, την αποζημίωση του κόστους των φαρμάκων στις κλινικές δοκιμές κλπ. (όπως προβλέπεται στο ν. 4812/ΦΕΚ Α΄110/30.06.2021) – (επικαιροποίηση του ΦΕΚ Β΄ 2015/03.06.2019)
- Δημιουργία Εθνικού Μητρώου Βιοιατρικής Έρευνας (Ε.Μη.Β.Ε.), όπως προβλέπεται στο ΦΕΚ Β΄ 4131/2016
- Ψηφιοποίηση στα νοσοκομεία/Έλεγχος δαπανών – Υποστήριξη κλινικών μελετών
- Ανάπτυξη των Μελετών Πραγματικού Κόσμου (Real World Evidence Studies) στη χώρα μας
Είναι σημαντικό και αξίζει να αναφερθεί ότι οι παραπάνω προτάσεις έχουν συζητηθεί με θετικό πνεύμα στις συναντήσεις της ομάδα εργασίας για την κλινική έρευνα, η οποία έχει συσταθεί με πρωτοβουλία του ΕΟΦ και στην οποία συμμετέχουν όλοι οι εμπλεκόμενοι φορείς (Υπουργείο Υγείας- Γενικός Γραμματέας Υπηρεσιών Υγείας, Εθνικός Οργανισμός Φαρμάκων – ΕΟΦ, Εθνική Επιτροπή Δεοντολογίας – ΕΕΔ, Σύνδεσμος Φαρμακευτικών Επιχειρήσεων Ελλάδας – ΣΦΕΕ, Πανελλήνια Ένωση Φαρμακοβιομηχανίας – ΠΕΦ, Σύλλογος Επιχειρήσεων Διεξαγωγής Κλινικών Μελετών Ελλάδας – HACRO).
Θα ήταν παράλειψη εάν από τη συζήτηση για την ανάπτυξη της κλινικής έρευνας στη χώρα μας απουσιάζει το θέμα των Μελετών Πραγματικού Κόσμου (Real World Evidence Studies). Δεν μπορεί σε Ευρωπαϊκό επίπεδο να υπάρχει εντονότατη κινητικότητα και οργάνωση για το συγκεκριμένο θέμα, ενώ στη χώρα μας να μην είναι ακόμη γνωστή και αποδεκτή η σημασία αυτών των μελετών! Πρόσφατα ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) ανακοίνωσε τη δημιουργία ενός κέντρου (ονομάζεται DARWIN EU®), για τη συλλογή και επεξεργασία περισσότερων δεδομένων δημόσιας υγείας (Real World Evidence-RWE) από τα κράτη μέλη της ΕΕ, με στόχο τη βελτίωση της γνώσης αναφορικά με τα νέα φάρμακα και την ταχύτερη πρόσβαση των ασθενών σε αυτά.
Οι RWE μελέτες παράγουν έγκυρα και αξιόπιστα στοιχεία από τον πραγματικό κόσμο, σχετικά με τις ασθένειες, τους ασθενείς και τη χρήση, την ασφάλεια και την αποτελεσματικότητα των φαρμάκων, συμπεριλαμβανομένων και των εμβολίων, γεγονός που μπορεί να οδηγήσει στη συντομότερη διάθεση καινοτόμων φαρμάκων στους ασθενείς. Οι RWE είναι η ομπρέλα κάτω από την οποία βρίσκονται και οι μη-παρεμβατικές μελέτες. Χρειάζεται να δημιουργηθεί το κατάλληλο πλαίσιο για τη διεξαγωγή αυτών των μελετών ως σύνολο (RWEs) και όχι αποσπασματικά για ένα τμήμα αυτού.
Η επόμενη ημέρα για την κλινική έρευνα έχει ήδη αρχίσει να χαράζει. Ο Νέος Ευρωπαϊκός Κανονισμός, η ολοένα αυξανόμενη χρήση της ψηφιακής τεχνολογίας, οι αποκεντρωμένες κλινικές δοκιμές (Decentralized Clinical Trials) θα είναι οι βασικοί πρωταγωνιστές. Εάν θέλουμε, ως χώρα, να είμαστε παρόντες στην επόμενη ημέρα, είναι απαραίτητο να λύσουμε άμεσα τα βασικά διαδικαστικά/γραφειοκρατικά προβλήματα που χρόνια τώρα μας ταλαιπωρούν και να ασχοληθούμε με τα ουσιαστικά ζητήματα.
Οι προτάσεις, οι οποίες φαίνεται ότι αντιμετωπίζονται θετικά από όλα τα εμπλεκόμενα μέρη, υπάρχουν και είναι τώρα η χρονική στιγμή για το επόμενο βήμα από την Πολιτεία. Ο ΣΦΕΕ θα συνεχίσει δυναμικά την προσπάθεια για να επιτευχθεί ο κοινός μας στόχος: να καταστήσουμε την Ελλάδα ελκυστική χώρα για την έλευση και τη διεξαγωγή κλινικών δοκιμών υψηλής ποιότητας με οφέλη για τον Ασθενή, τους Επιστήμονες Υγείας αλλά και την Οικονομία γενικότερα.
Ιωάννης Χονδρέλης, PhD.
Διευθυντής Ιατρικού Τμήματος ΦΑΡΜΑΣΕΡΒ-ΛΙΛΛΥ.
Συντονιστής Ομάδας Κλινικών Μελετών ΣΦΕΕ.