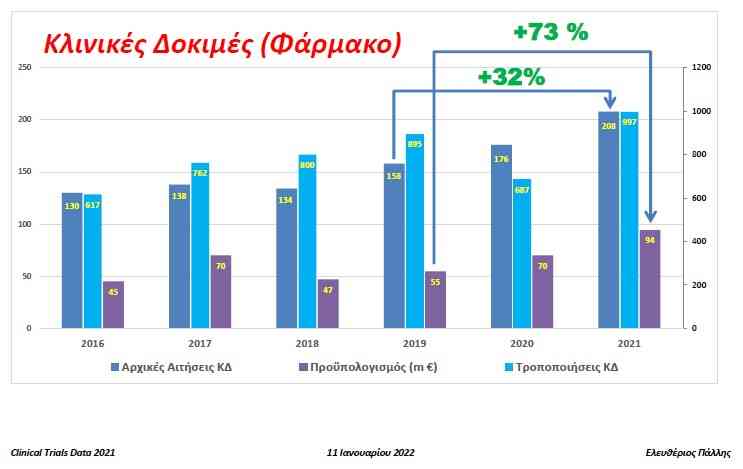
Το 2021 φαίνεται πως ήταν ένας κρίσιμος χρόνος για τις επιδόσεις της χώρας μας στις Κλινικές Δοκιμές που δημιουργεί αισιοδοξία για το μέλλον. Πέρα από την μικρή σταθερή αύξηση τα προηγούμενα χρόνια (134 το 2018, 158 το 2019, 175 το 2020) οι Κλινικές Δοκιμές φαρμάκων εκτοξεύθηκαν το 2021 στις 208 (+32% από το 2019) με προϋπολογισμό 94,323 εκ. ευρώ (+73% από το 2019). Και οι δύο επιδόσεις είναι οι μέγιστες που έχουν επιτευχθεί έως σήμερα στην Ελλάδα, όπως είπε στο healthview o Ελευθέριος Πάλλης, Αντιπρόεδρος του Εθνικού Οργανισμού Φαρμάκων:
«Καταφέραμε μέσα σε δύο χρόνια να αναπτύξουμε ένα περιβάλλον συνεργασίας και γόνιμου διαλόγου με όλους τους εμπλεκόμενους φορείς και να προχωρήσουμε αρκετά βήματα στην  κατεύθυνση της οργάνωσης και της επιτάχυνσης των διαδικασιών. Το αποτέλεσμα είναι οι χρόνοι έγκρισης να έχουν μειωθεί στο ελάχιστο και να έχουμε ιστορικά τις μεγαλύτερες επιδόσεις τόσο σε αριθμό αιτήσεων κλινικών μελετών, όσο και στον προϋπολογισμό τους».
κατεύθυνση της οργάνωσης και της επιτάχυνσης των διαδικασιών. Το αποτέλεσμα είναι οι χρόνοι έγκρισης να έχουν μειωθεί στο ελάχιστο και να έχουμε ιστορικά τις μεγαλύτερες επιδόσεις τόσο σε αριθμό αιτήσεων κλινικών μελετών, όσο και στον προϋπολογισμό τους».
Οι κλινικές μελέτες μετά την πανδημία.
Είναι βέβαιο ότι η πανδημία επιτάχυνε, αν μη τι άλλο, την μετάβαση στην ψηφιακή εποχή καθώς τα αιτήματα προς τον ΕΟΦ για κλινικές δοκιμές και οι απαντήσεις του Οργανισμού διεκπεραιώνονται πλέον ηλεκτρονικά, από το Μάρτιο του 2020, με έγκαιρο σχεδιασμό και προετοιμασία.
Πέρα από τον «επιταχυντή» της πανδημίας, υπήρχε ένα οργανωμένο σχέδιο για τη διετία 2020-2021 και έγιναν αρκετά βήματα. Έτσι, όσον αφορά στο εσωτερικό περιβάλλον του ΕΟΦ εκτός από πρωτοβουλίες για την ενίσχυση και την εκπαίδευση των εργαζομένων του, πολύ σημαντική ήταν η ανάπτυξη ενός συστήματος καταγραφής των δεδομένων των αιτήσεων των κλινικών δοκιμών («βάση δεδομένων» κλινικών δοκιμών) κάτι που όσο κι αν φαίνεται περίεργο δεν υπήρχε μέχρι πρόσφατα. Επίσης ξεκίνησε η συνεχής και πλήρης δημοσιοποίηση των δεδομένων αυτών στο website του Οργανισμού, εξασφαλίζοντας πέρα από την έγκαιρη και έγκυρη πληροφόρηση όλων των ενδιαφερόμενων και την διάσταση της διαφάνειας.
Σε σχέση με το περιβάλλον εκτός Οργανισμού οργανώθηκαν συνεργασίες (Ομάδες Εργασίας κλπ) και δράσεις με όλο το πλέγμα των ενδιαφερόμενων κοινωνικών εταίρων (βλ. παρακάτω) ενώ ιδιαίτερα σημαντικό βήμα ήταν η συστηματική συνεργασία του Οργανισμού με την Ένωση Ασθενών Ελλάδας και η διασύνδεση του website της Ένωσης Ασθενών με αυτό του ΕΟΦ για την παροχή έγκυρης και έγκαιρης ενημέρωσης και πληροφόρησης τους.
 Από την πλευρά του Υπουργείου Υγείας, είναι σαφές ότι υπάρχει αντίληψη και της επιστημονικής και της υγειονομικής (οφέλη για ασθενείς) αλλά και της αναπτυξιακής σημασίας των κλινικών μελετών. Έτσι, τα τελευταία δύο χρόνια μια σειρά από Νομοθετικές Πράξεις και Ρυθμίσεις, «ξεκόλλησαν» διάφορα χρονίζοντα θέματα και έδωσαν μια πρώτη ώθηση στην αύξηση των κλινικών μελετών. Σημαντικότερο ήταν το νομοθετικό πλαίσιο για συμψηφισμό του clawback με ποσοστά επί των δαπανών έρευνας και ανάπτυξης, Επίσης η επίδραση της διενέργειας κλινικών δοκιμών στα Νοσοκομεία στην συνολική αξιολόγηση του έργου των Διοικητών τους, καθώς και η ρύθμιση της έγκρισης των Μη-Παρεμβατικών κλινικών μελετών που εκκρεμούσε επί μακρόν.
Από την πλευρά του Υπουργείου Υγείας, είναι σαφές ότι υπάρχει αντίληψη και της επιστημονικής και της υγειονομικής (οφέλη για ασθενείς) αλλά και της αναπτυξιακής σημασίας των κλινικών μελετών. Έτσι, τα τελευταία δύο χρόνια μια σειρά από Νομοθετικές Πράξεις και Ρυθμίσεις, «ξεκόλλησαν» διάφορα χρονίζοντα θέματα και έδωσαν μια πρώτη ώθηση στην αύξηση των κλινικών μελετών. Σημαντικότερο ήταν το νομοθετικό πλαίσιο για συμψηφισμό του clawback με ποσοστά επί των δαπανών έρευνας και ανάπτυξης, Επίσης η επίδραση της διενέργειας κλινικών δοκιμών στα Νοσοκομεία στην συνολική αξιολόγηση του έργου των Διοικητών τους, καθώς και η ρύθμιση της έγκρισης των Μη-Παρεμβατικών κλινικών μελετών που εκκρεμούσε επί μακρόν.
Όπως αναφέρει ο Γενικός Γραμματέας Υπηρεσιών Υγείας του Υπουργείου Ιωάννης Κωτσιόπουλος «Παραμείναμε εστιασμένοι στον αρχικό μας στόχο για ανάπτυξη της κλινικής έρευνας στη χώρα και παρά τις βαρύτατες επιπτώσεις της πανδημίας στις δομές και τις λειτουργίες του Συστήματος Υγείας έχουμε ήδη επιτύχει σημαντικά και μετρήσιμα αποτελέσματα σε ότι αφορά τις κλινικές μελέτες που διεξάγονται στη χώρα.
Βασικός πυλώνας της αναπτυξιακής πολιτικής μας παραμένει το πλαίσιο που επιτρέπει το συμψηφισμό της αυτόματης επιστροφής clawback με ποσοστά επί των δαπανών έρευνας και ανάπτυξης και των δαπανών επενδυτικών σχεδίων ανάπτυξης προϊόντων ή υπηρεσιών ή γραμμών παραγωγής («επενδυτικό clawback») ενώ σειρά άλλων πρωτοβουλιών είχε στόχο να ρυθμίσει ζητήματα που προκαλούσαν εμπόδια και καθυστερήσεις στην ανάπτυξη της κλινικής έρευνας όπως π.χ. η ρύθμιση της διαδικασίας έγκρισης των μη παρεμβατικών κλινικών μελετών.
Με συνεχή συνεργασία με τον Εθνικό Οργανισμό Φαρμάκων και όλους τους εμπλεκόμενους φορείς έχουμε δρομολογήσει τις επόμενες δράσεις μας που περιλαμβάνουν σημαντικές βελτιώσεις θεσμικού χαρακτήρα αλλά και νέα έργα τα οποία έχουμε καταφέρει να εντάξουμε στο Ταμείο του Μηχανισμού Ανάκαμψης και Ανθεκτικότητας-RRF, όπως η ανάπτυξη Ολοκληρωμένου Πληροφοριακού Συστήματος της Κλινικής Έρευνας. Θεωρούμε ότι η νέα χρονιά θα μας βρει έτοιμους για την περαιτέρω επιτάχυνση των προσπαθειών μας σχετικά με την ανάπτυξη της κλινικής έρευνας στη χώρα».
Πως θα καλύψουμε την απόσταση από την υπόλοιπη Ευρώπη.
Παρά τα ενθαρρυντικά στοιχεία του 2021, και την σχετική επιτάχυνση των διαδικασιών, υστερούμε ακόμα από άλλες ευρωπαϊκές χώρες. Ουσιαστικά δεν έχουμε καταφέρει να προσελκύσουμε τις κλινικές μελέτες που θα μπορούσαμε με βάση την αναλογία του πληθυσμού της χώρας μας εντός της Ε.Ε. Ούτε έχουμε αξιοποιήσει όσο θα μπορούσαμε το υψηλότατο επίπεδο ιατρών και λοιπών επαγγελματιών υγείας που συμμετέχουν, αλλά και των νοσηλευτικών ιδρυμάτων μας (Δημόσια και Ιδιωτικά Νοσοκομεία, Πανεπιστημιακά αλλά και του Εθνικού Συστήματος Υγείας) που καλύπτουν τα απαραίτητα υψηλά πρότυπα (standards) των Ευρωπαϊκών (π.χ. ΕΜΑ) αλλά και άλλων Διεθνών Οργανισμών (π.χ. FDA).
Τι μέλλει γενέσθαι; Όπως μας ενημέρωσε ο Αντιπρόεδρος του ΕΟΦ, κος Ελευθέριος Πάλλης, στους άμεσους στόχους περιλαμβάνονται:
- Η ανάπτυξη και λειτουργία Ενιαίου Ολοκληρωμένου Πληροφοριακού Συστήματος στο οποίο θα υπάρχουν όλα τα δεδομένα των κλινικών δοκιμών που διεξάγονται στη χώρα και θα αποτελέσει την πρόδρομη μορφή του Εθνικού Μητρώου Βιοϊατρικής Έρευνας (Ε.Μη.Β.Ε.).
- Η (πιλοτική) λειτουργία Γραφείων Κλινικής Έρευνας σε κάποια Νοσοκομεία της χώρας με σκοπό την επιτάχυνση των διαδικασιών και την ορθή εφαρμογή του υφιστάμενου πλαισίου έτσι ώστε να αναπτυχθεί η κλινική έρευνα.
- Η ανάπτυξη ενιαίων διαδικασιών και προτύπων που αφορούν την διεξαγωγή της κλινικής έρευνας στη χώρα.
- Η προώθηση περαιτέρω νομοθετικών πράξεων και ρυθμίσεων που θα επιτρέψουν την ανάπτυξη της κλινικής, και εν γένει βιοϊατρικής, έρευνας στη χώρα.
Το ενθαρρυντικό είναι ότι οι ανωτέρω συγκεκριμένες προστάσεις έχουν συζητηθεί – με θετικό πνεύμα- στις αρμόδιες Ομάδες Εργασίας και με όλους τους ενδιαφερόμενους εταίρους. (Υπουργείο Υγείας- Γενικός Γραμματέας Υπηρεσιών Υγείας, Εθνικός Οργανισμός Φαρμάκων, Εθνική Επιτροπή Δεοντολογίας, Σύνδεσμος Φαρμακευτικών Επιχειρήσεων Ελλάδας, Πανελλήνια Ένωση Φαρμακοβιομηχανίας, Σύλλογος Επιχειρήσεων Διεξαγωγής Κλινικών Μελετών Ελλάδας).
Από την πλευρά της φαρμακοβιομηχανίας (Σύνδεσμος Φαρμακευτικών Εταιρειών Ελλάδας – ΣΦΕΕ), όπως έχει δηλωθεί επανειλημμένως, στόχος του Συνδέσμου και των μελών του, είναι να αυξηθούν οι επενδύσεις και να γίνει η χώρα μας κέντρο διεξαγωγής κλινικών μελετών με προφανή θετικό αντίκτυπο στη Δημόσια Υγεία και την Εθνική Οικονομία. Άρα διαχρονικά επιζητείται βελτίωση του ρυθμιστικού πλαισίου, με μεγαλύτερη ευελιξία και επιτάχυνση των διαδικασιών και κυρίως στα Νοσοκομεία όπου απουσιάζει η ερευνητική «κουλτούρα», επικρατεί άγνοια των διοικήσεων και ορθώνονται πολλά γραφειοκρατικά «αναχώματα» στις κλινικές μελέτες όπως διαπίστωσε έρευνα του ΣΦΕΕ στο τέλος του 2019.
Επιπροσθέτως, τον Ιούλιο του 2021 ο ΣΦΕΕ παρουσίασε τη μελέτη της PwC: «Πώς θα προσελκύσει κλινικές μελέτες η Ελλάδα», η οποία πέρα από την καταγραφή των δομικών προβλημάτων αναλύει μια σειρά προτάσεων με βάση και τις καλές πρακτικές σε άλλες ευρωπαϊκές χώρες. Βασική πρόταση του ΣΦΕΕ είναι η δημιουργία Επιτελικής Δομής στο Υπουργείο, αλλά και Γραφεία Έρευνας σε όλα τα μεγάλα νοσοκομεία της χώρας, που θα λειτουργούν ως one-stop-shop.

Όπως σημείωσε για το heathview ο Αντιπρόεδρος του Δ.Σ. του ΣΦΕΕ και υπεύθυνος Επιστημονικών Θεμάτων και Κλινικών Μελετών, κ. Δημήτρης Αναγνωστάκης: «Απαιτείται στενή συνεργασία όλων των αρμοδίων, ώστε να βρεθούν συναινετικές λύσεις που θα αναδείξουν τις δυνατότητες της χώρας και θα την καταστήσουν κέντρο διεξαγωγής κλινικών μελετών με διεθνή απήχηση. Την τελευταία διετία έγιναν βήματα προς τη σωστή κατεύθυνση, ωστόσο χρειαζόμαστε ένα, ακόμα πιο απλουστευμένο και λιγότερο γραφειοκρατικό πλαίσιο διεκπεραίωσης για τις κλινικές μελέτες, για να γίνουμε πιο ανταγωνιστικοί από τις άλλες χώρες».
Το σύνθετο πλέγμα των εμπλεκομένων.
Στη διαδικασία υλοποίησης μιας κλινικής μελέτης συνυπάρχουν πολλοί εμπλεκόμενοι εταίροι. Οι δυο προφανείς είναι οι ερευνητές και οι εθελοντές (ασθενείς, αλλά και υγιείς σε κάποιες περιπτώσεις). Από εκεί και πέρα χρειάζεται η χρηματοδότηση κάποιου Χορηγού (συνήθως Φαρμακευτική Εταιρεία) που έχει ερευνητικό ενδιαφέρον. Μπορεί όμως να γίνουν και με χρηματοδότηση από ερευνητικά ιδρύματα, πανεπιστήμια, οργανισμούς (αυτοχρηματοδότηση-«Μη-εμπορικές κλινικές μελέτες» όπως ονομάζονται) που διενεργούνται από ερευνητές χωρίς τη συμμετοχή χορηγίας από τη φαρμακοβιομηχανία. Στο πεδίο της φαρμακοβιομηχανίας οι σύνδεσμοι ΣΦΕΕ, ΠΕΦ (Πανελλήνια Ένωση Φαρμακοβιομηχανίας) και PIF (Pharma Innovation Forum) έχουν τον θεσμικό ρόλο που τους αναλογεί.
Φυσικά είναι απαραίτητες οι εγκρίσεις και ο έλεγχος σε πολλά διαφορετικά στάδια. Στην Ελλάδα, οι κλινικές μελέτες για φάρμακα ανθρώπινης χρήσης διεξάγονται μετά από αξιολόγηση και έγκριση του Εθνικού Οργανισμού Φαρμάκων (ΕΟΦ) και εφόσον έχει γνωμοδοτήσει θετικά η Εθνική Επιτροπή Δεοντολογίας (ΕΕΔ), ενώ οι εμπλεκόμενοι εταίροι, είναι οι χορηγοί, τα Νοσοκομεία/Φορείς Παροχής Υπηρεσιών Υγείας (όπου διεξάγεται η μελέτη), οι εκάστοτε Φορείς Οικονομικής Διαχείρισης (ΥΠΕ-ΕΛΚΕΑ, Πανεπιστήμια-ΕΛΚΕ), ο Σύλλογος Επιχειρήσεων Διεξαγωγής Κλινικών Μελετών Ελλάδας- HACRO (CROs-Contract Research Organizations, σχεδιάζουν, διαχειρίζονται, παρακολουθούν και διεξάγουν Κλινικές Μελέτες, για λογαριασμό των χορηγών φαρμακευτικών εταιρειών) και προφανώς το Υπουργείο Υγείας.
Φάσεις και κλινικές δοκιμές στην Ελλάδα.
Η διαδικασία των κλινικών δοκιμών θεωρείται η πιο χρονοβόρα και ακριβή φάση ανάπτυξης ενός νέου φαρμάκου. Κάθε νέο υποψήφιο φάρμακο, αφού κατοχυρωθεί η πατέντα του, ξεκινά την διαδικασία των κλινικών δοκιμών που περιλαμβάνει 3+1 φάσεις:
Στη Φάση Ι το υποψήφιο φάρμακο δοκιμάζεται σε μικρό αριθμό υγειών εθελοντών για να διαπιστωθεί κυρίως αν είναι ασφαλές για χρήση στον άνθρωπο (τοξικότητα, ανοχή, ανεπιθύμητες ενέργειες κλπ). Στη φάση αυτή συμμετέχουν περίπου 20 έως 100 εθελοντές και στην Ελλάδα έχουμε κατά κανόνα πολύ λίγες μελέτες αυτής της Φάσης.
Στη Φάση II εξετάζεται η ασφάλεια και η δραστικότητα του υποψήφιου φαρμάκου στην ασθένεια για την οποία προορίζεται. Εδώ ο αριθμός εθελοντών ξεκινά από 50 και φτάνει έως 500. Στη Φάση αυτή προσδιορίζεται και η κατάλληλη δοσολογία.
Η Φάση III είναι αυτή πριν την έγκριση του φαρμάκου. Για αυτό συμμετέχει μεγάλος αριθμός ασθενών (έως 5.000). Οι ερευνητές αναζητούν δεδομένα, για να αποδείξουν ότι το φάρμακο πληροί τις προϋποθέσεις ασφάλειας και αποτελεσματικότητας, προκειμένου να πάρει έγκριση.
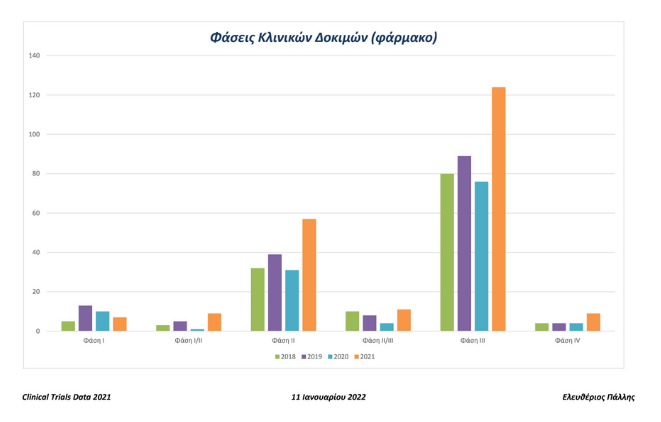
Στην Ελλάδα οι αιτήσεις μελετών Φάσης III το 2021, φθάσανε τις 124 έναντι 76 το 2020 και 89 το 2019 και οι αιτήσεις μελετών Φάσης IV ήταν 9 το 2021 έναντι 4 το 2020 και 4 το 2019.
Τέλος, ακόμα και μετά την έγκριση ενός φαρμάκου και την κυκλοφορία του στην αγορά, συνεχίζουν να διενεργούνται κλινικές μελέτες Φάσης IV, όπου ελέγχεται ακόμα περισσότερο η ασφάλεια του φαρμάκου σε συνθήκες κλινικής πρακτικής.
Με στόχο τους ασθενείς …… αλλά και την ανάπτυξη!
Έχουν γίνει λοιπόν σημαντικά βήματα για την προσέλκυση επενδύσεων για κλινικές δοκιμές, ωστόσο τα περιθώρια βελτίωσης είναι πολύ μεγάλα. Η κατά κεφαλήν επένδυση σε κλινικές μελέτες στην Ελλάδα παραμένει στο μόλις 10% του μέσου όρου της Ευρώπης. Με δεδομένο ότι ο συγκεκριμένος τομέας είναι διεθνώς ιδιαίτερα ανταγωνιστικός, (και οι άλλες χώρες ενδιαφέρονται να προσελκύσουν επενδύσεις) θα πρέπει να υιοθετηθούν, το συντομότερο, μέτρα που θα διευκολύνουν και θα επιταχύνουν την υλοποίηση κλινικών μελετών στην Ελλάδα.
Όπως σημειώνει ο Αντιπρόεδρος του ΕΟΦ Ελευθέριος Πάλλης «η ανάπτυξη ερευνητικού προσανατολισμού (η ερευνητική «κουλτούρα» που αναφέρθηκε) στις δομές υγείας που εμπλέκονται στη διεξαγωγή της κλινικής έρευνας, οι αλλαγές/βελτιώσεις στο ρυθμιστικό πλαίσιο (διαδικασίες κλπ), η παροχή κινήτρων και η αξιοποίηση των νέων τεχνολογιών αναμένεται να εξαλείψουν ή τουλάχιστον να μειώσουν πολύ τη γραφειοκρατία και τις καθυστερήσεις και να ενισχύσουν την ανταγωνιστικότητα της χώρας μας στον τομέα αυτό. Η ανάπτυξη περιβάλλοντος που εγγυάται σταθερότητα, συνέπεια και αξιοπιστία στις διαδικασίες είναι ιδιαίτερα σημαντική».
Σύμφωνα με το Γενικό Γραμματέα Υπηρεσιών Υγείας, Ιωάννη Κωτσιόπουλο «απώτερος στόχος είναι να καταστεί η Ελλάδα ανταγωνιστικός προορισμός Βιοϊατρικής Έρευνας, να ενισχυθεί οικονομικά το Σύστημα Υγείας, να δημιουργηθούν νέες θέσεις εργασίας επιστημόνων υψηλότατης κατάρτισης (Brain Gain), να αναπτυχθεί η εξειδικευμένη εκπαίδευση του ερευνητικού ανθρώπινου δυναμικού της χώρας, η τεχνογνωσία, η έρευνα, η καινοτομία και, εν τέλει, η εθνική οικονομία».
Για να γίνουν όμως όλα αυτά χρειάζεται και ο σχεδιασμός (που φαίνεται πως υπάρχει) χρειάζονται και πολιτικές αποφάσεις, χρειάζονται και κατάλληλοι άνθρωποι σε κατάλληλες θέσει. Μόνο με ολιστική προσέγγιση, ο τομέας της Βιοϊατρικής Έρευνας θα αναδειχθεί έτσι όπως τον περιγράφει ο Αντιπρόεδρος του ΕΟΦ και θα μπορέσει να επιστρέψει προστιθέμενη αξία στη χώρα μας.
Σε κάθε περίπτωση να μην ξεχνούμε ότι οι κλινικές δοκιμές έχουν ως «στόχο» πάντα τον ασθενή και τις ανάγκες του και ότι χωρίς τις κλινικές δοκιμές δεν θα μπορούσαν να αναπτυχθούν, καινοτόμες, πιο αποτελεσματικές και ασφαλείς θεραπευτικές παρεμβάσεις. Επίσης υπάρχουν και πρόσθετα οφέλη για τους ασθενείς, αφού τους δίνεται η ευκαιρία να λάβουν γρήγορα και δωρεάν, καινοτόμα φάρμακα, αλλά και να κάνουν διαγνωστικές εξετάσεις ενώ παράλληλα τους προσφέρεται συνεχής, υψηλού επιπέδου ιατρική παρακολούθηση.
Στη διετία 2020-21 στην Ελλάδα συμμετείχαν και ωφελήθηκαν από τις κλινικές δοκιμές περίπου 13.650 ασθενείς. Μπορούμε να τους πολλαπλασιάσουμε;