Από τις 31/1/2022 με έκδηλη ικανοποίηση η Ευρώπη χαιρετίζει την έναρξη της ισχύος του νέου Ευρωπαϊκού Κανονισμού για τις Κλινικές Δοκιμές . Με αισιόδοξες δηλώσεις οι ευρωπαϊκές αρχές ,η φαρμακοβιομηχανία και οι ευρωπαίοι καταναλωτές εκθειάζουν τη σημασία της ισχύος των νέων κανόνων και του πληροφοριακού συστήματος κλινικών δοκιμών που τέθηκαν σε ισχύ. Όλοι καλωσορίζουμε τη «νέα αυγή» στην κλινική έρευνα, παρά την καθυστέρηση 8 ετών από την ψήφιση του νέου κανονισμού για τις κλινικές δοκιμές τον Απρίλιο του 2014, που προοιωνίζει την αρχή μιας νέας συναρπαστικής φάσης για τους ασθενείς και τα συστήματα υγείας στην Ευρώπη για καλύτερης ποιότητας υγειονομική περίθαλψη.
Η Ευρώπη πλέον είναι ένα βήμα πιο κοντά στη διασφάλιση ενός ευνοϊκού περιβάλλοντος για τη διεξαγωγή κλινικών δοκιμών, με τα υψηλότερα πρότυπα ασφάλειας των ασθενών, για όλα τα κράτη μέλη της Ευρωπαϊκής Ενωσης(ΕΕ). Οι ασθενείς θα είναι «οι κύριοι δικαιούχοι των κλινικών δοκιμών» και τα ερευνητικά ιδρύματα και οι χορηγοί θα εξοικονομούν 1 δισεκατομμύριο δολάρια ετησίως σε ρυθμιστικές δαπάνες, ενώ θα διατηρούν την κλινική έρευνα εντός των συνόρων της Ευρωπαϊκής Ενωσης.
Εύλογα αισιοδοξούμε ενώ παράλληλα οφείλουμε να βελτιώσουμε τις αδυναμίες του ελληνικού περιβάλλοντος ,που έχουν επανειλημμένως προσδιοριστεί, ώστε να αποφύγουμε το “déjà vu”,και να αναβαθμίσουμε την ανταγωνιστικότητα μας εντός Ευρώπης.
Οι ενώσεις ασθενών αναγνωρίζουν ότι ο νέος κανονισμός ,βάζει το δημόσιο συμφέρον πάνω από τα εμπορικά συμφέροντα και ότι θα ενισχύει την διαφάνεια των κλινικών δοκιμών με την έγκαιρη δημοσιοποίηση των αποτελεσμάτων τους.
Ο κανονισμός 536/2014 θα επαυξήσει την εμπιστοσύνη των πολιτών στις κλινικές δοκιμές και έχει την προοπτική να σώσει πολλές ζωές.
Η νέα νομοθεσία θα συμβάλει στην προώθηση μιας πιο εναρμονισμένης προσέγγισης των κλινικών δοκιμών στην Ευρωπαϊκή Ένωση, με μια ενιαία υποβολή και συνολική ορθολογική διαδικασία αξιολόγησης.
Η επιτυχία της νέας νομοθεσίας θα κριθεί στην πράξη. Η παγκόσμια και η κοινοτική αγορά για τις κλινικές δοκιμές γίνεται ολοένα και πιο ανταγωνιστική. Η Ελλάδα θα πρέπει να αναπτύξει ταχύτητες και να επιδείξει ηγεσία παραγωγικού μετασχηματισμού της σε γονιμότερο περιβάλλον για την έρευνα και τις κλινικές δοκιμές. Ορισμένες προτεραιότητες που απαιτούν επείγουσα προσοχή είναι η εμβάθυνση της συνεργασίας μεταξύ όλων των εταίρων : μη εμπορικών χορηγών (ακαδημαϊκών & επιστημονικών εταιρειών) ,εμπορικών χορηγών, Εθνικής Επιτροπής Δεοντολογίας για τις κλινικές δοκιμές ,του Εθνικού Οργανισμού Φαρμάκων, ενώσεων ασθενών, με εξασφάλιση των απαραιτήτων δεξιοτήτων σε όλο το οικοσύστημα, για την πλήρη και εμπρόθεσμη εφαρμογή των βελτιστοποιημένων επιστημονικών & δεοντολογικών προϋποθέσεων παράλληλα με την διασφάλιση της ποιότητας δεδομένων των κλινικών δοκιμών.
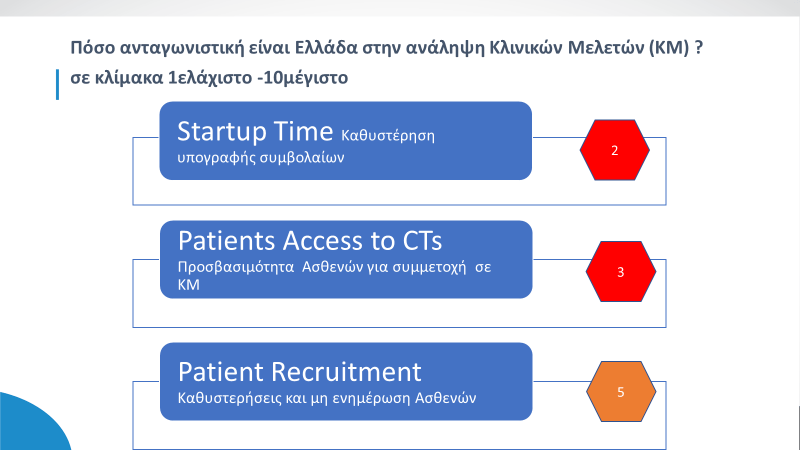
Μέχρι τώρα, οι περισσότερες εργασίες που απαιτούνται για την έναρξη της εισαγωγής ασθενών στις κλινικές μελέτες μπορούσαν σε μεγάλο βαθμό να προγραμματισθούν και να υλοποιηθούν ανεξάρτητα ανά κέντρο , με ελάχιστο συντονισμό μεταξύ των συντονιστών της μελέτης, στα διάφορα κέντρα και χώρες .Η εστίαση αφορούσε στην πρώτη έγκριση σε ένα κέντρο ,σε μια χώρα, γνωρίζοντας ότι θα ακολουθήσουν πρόσθετες καταθέσεις και εγκρίσεις κέντρων και χωρών.
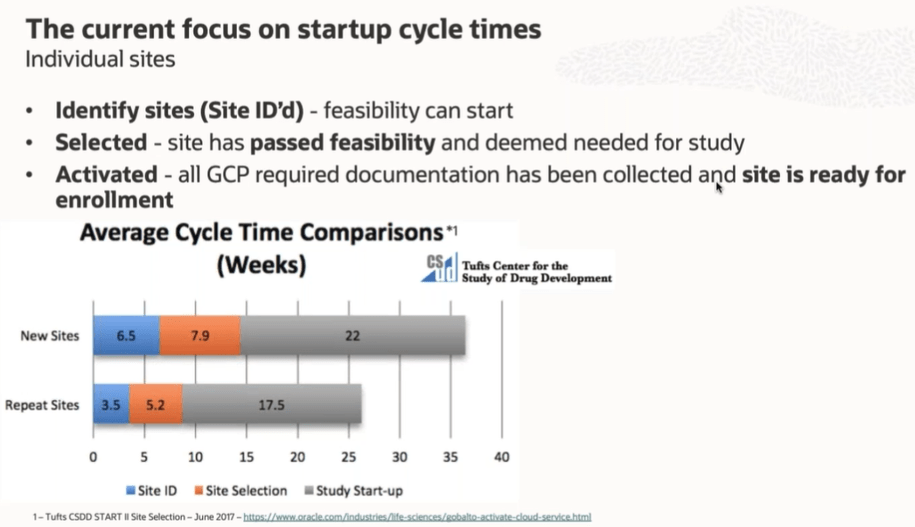
Διάγραμμα χρόνου έναρξης (startup cycle) – διεθνή δεδομένα (έμπειρα κέντρα vs νέα κέντρα) – Tufts Center for the Study of Drug Development.
Αυτό το αποκεντρωμένο μοντέλο πλέον μοντέλο δεν θα ισχύει στην ΕΕ ,όπου ο νέος κανονισμός θεωρεί τα «κράτη μέλη ως ενιαίο περιβάλλον» με ενιαία διαδικασία ταυτοσήμων προδιαγραφών, όπου το «τελευταίο» κέντρο μπορεί να «συμπαρασύρει σε καθυστέρηση» όλο το δίκτυο της κλινικής δοκιμής με τις προφανείς ανεπιθύμητες συνέπειες.
Ο 536/2014 αντιπροσωπεύει αναμφισβήτητα μια «αλλαγή παραδείγματος».
Το αφανές μυστικό του Νέου Κανονισμού είναι « ο συγχρονισμός με την ταχύτητα των ενιαίων και προκαθορισμένων ευρωπαϊκών χρόνων έγκρισης» ώστε να κλειδώσει η επιτυχία του κανονισμού εντός της Ευρώπης για τα κράτη μέλη και τους χορηγούς των κλινικών δοκιμών.
Επειδή επιδιώκουμε να είμαστε σαν χώρα στην 1η γραμμή για την προσέλκυση κλινικών δοκιμών ,θα πρέπει να ανταποκριθούμε πλήρως ,στρατηγικά ,χρονικά και ποιοτικά στις απαιτήσεις του 536/2014.
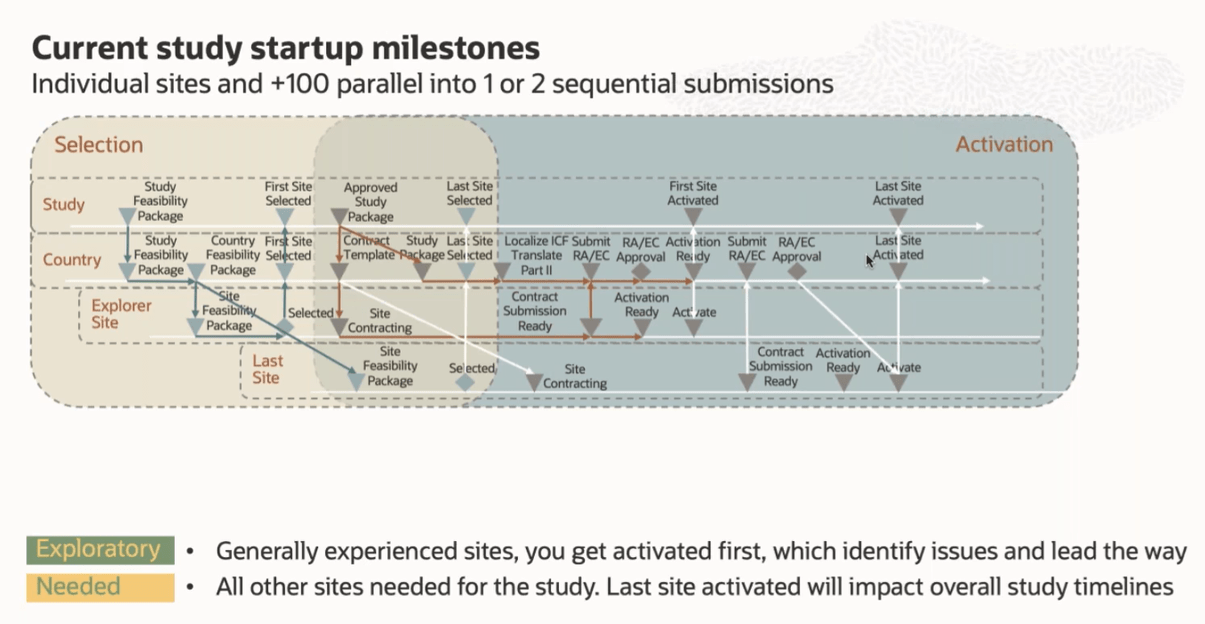
Από τον Ιανουάριο του 2023, η Ευρωπαϊκή Ένωση απαιτεί να υποβάλλονται όλες οι νέες μελέτες βάσει του κανονισμού 536/2014 και να χρησιμοποιείται το Πληροφοριακό Σύστημα Κλινικών Δοκιμών (CTIS) για υποβολές — πράγμα που σημαίνει ότι όλες οι χώρες και τα κέντρα που θα συμμετέχουν σε πολυεθνικές μελέτες πρέπει να επιλεγούν πριν από τον Ιούλιο του 2022, ώστε να προετοιμασθούν
- είτε ως κέντρα με εμπειρία (exploratory) για τον 1ο γύρο της κατάθεσης (Πίνακας 1)
- είτε ως τα αναγκαία κέντρα (needed) για την μελέτη για το 2ο γύρο της κατάθεσης (Πίνακας1)
Ο επιχειρησιακός σχεδιασμός των καταθέσεων των μελετών θα πρέπει να ακολουθήσει τις προδιαγραφές του νέου κανονισμού, διαφορετικά μεγάλες πολυκεντρικές μελέτες διατρέχουν κίνδυνο σημαντικής καθυστέρησης ή και μη διεξαγωγής στην Ελλάδα.
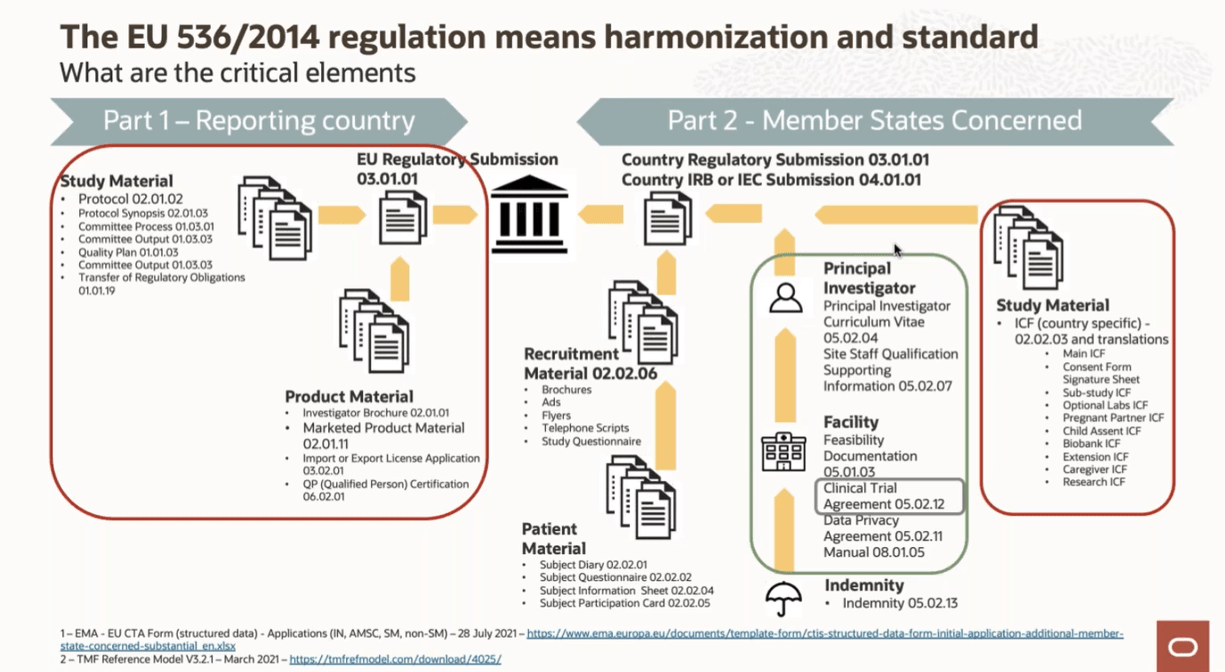
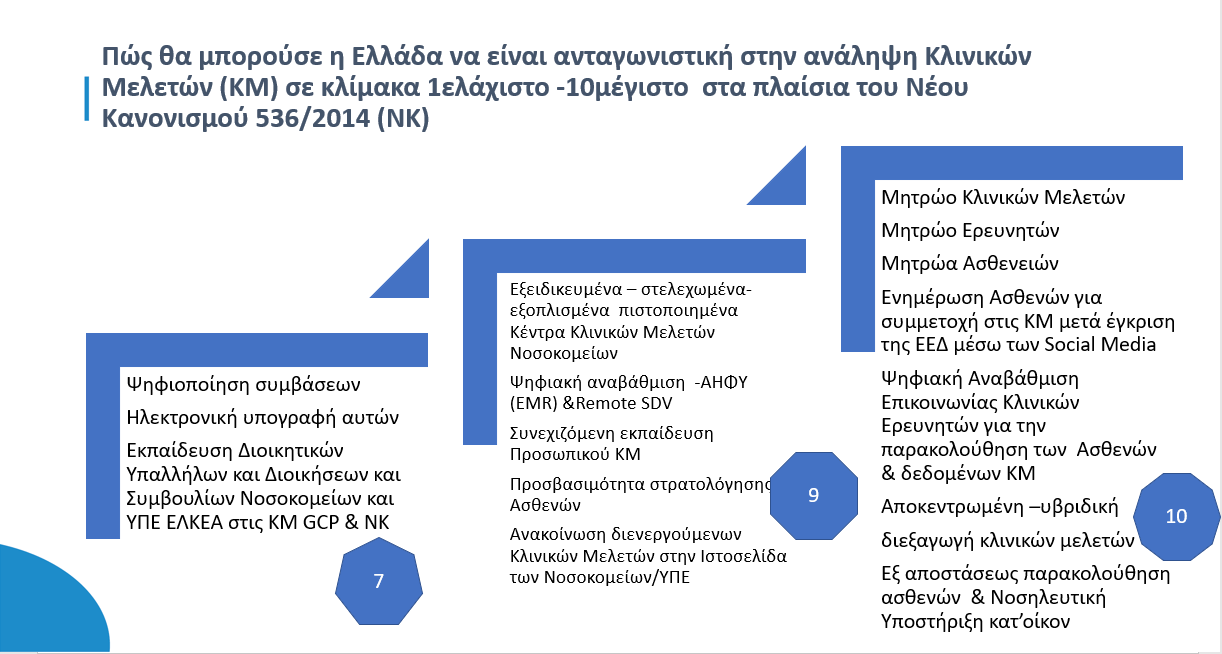
Η επιτυχής εναρμόνιση μας με τον 536/2014 θα απαιτήσει συντονισμένο, λεπτομερή σχεδιασμό και διαχείριση των κλινικών δοκιμών στην χώρα, που θα πρέπει να τον επιμεληθεί ο χορηγός πολύ νωρίς ,αφού αξιολογήσει εγκαίρως το περιβάλλον των υποψηφίων Νοσοκομείων /ΥΠΕ/ΕΛΚΕΑ/ΕΛΚΕ με πρότυπες διαδικασίες ,συγκεκριμένα χρονοδιαγράμματα και συστηματική παρακολούθηση τους.
Η εκπόνηση στρατηγικού σχεδιασμού της περιόδου start up είναι αναγκαία & απαιτητή για την ετοιμότητα υποβολής αίτησης διεξαγωγής κλινικής δοκιμής στα πλαίσια του κανονισμού.
Σε κεντρικό επίπεδο της χώρας θα πρέπει να προσδιορισθούν τα επιτελικά σημεία για την επιτυχή εφαρμογή του κανονισμού 536/2014 για τις κλινικές δοκιμές, συγκεκριμένα για :
- να προβλεφθούν τα στρατηγικά σημεία της start up διαδικασίας και να αποφευχθούν τα κρίσιμα σημεία «συμφόρησης» σε τοπικό επίπεδο
- να κάνουμε ακριβείς προσομοιώσεις start up με σενάρια χρονικής προετοιμασίας υποβολής του φακέλου της μελέτης στην χώρα
Στην εκπόνηση της ετοιμότητας του εθνικού μηχανισμού για την αναπτυξιακή δυναμική των κλινικών δοκιμών απαιτείται η προτεραιοποίηση δράσεων , χρόνων και διαδικασιών επιλογής και προετοιμασίας των ερευνητικών κέντρων (Startup Time),η πρόσβαση και ενημέρωση των ασθενών για συμμετοχή σε κλινικές μελέτες.
21 Φεβρουαρίου 2022 Βαρβάρα Μπαρούτσου
Επιπρόσθετα η επιμέλεια οργανωσιακών ,διαχειριστικών και ψηφιακών δεξιοτήτων ,η επιτάχυνση του ψηφιακού μετασχηματισμού στο νοσοκομειακό περιβάλλον, της χρήσης νέων τεχνολογιών, της αποκεντρωμένης υβριδικής διεξαγωγής των κλινικών δοκιμών, της εξ’ αποστάσεως παρακολούθησης των ασθενών, της καθιέρωσης του εθνικού ατομικού ηλεκτρονικού φακέλου υγείας και στις κλινικές δοκιμές όπως και της απομακρυσμένης επιτήρησης (Source Data Verification -SDV), θα αναβάθμιζαν την επιλογή της χώρας για κλινικές δοκιμές.
21 Φεβρουαρίου 2022 Βαρβάρα Μπαρούτσου
Η μετάβαση της Ελλάδας στον νέο κανονισμό ,στην ψηφιακή εποχή των κλινικών δοκιμών , της τεχνητής συλλογικής νοημοσύνης και των μεγάλων δεδομένων στην υγεία , συνιστά μια αλλαγή διαρκείας, που θα επηρεάσει την λειτουργία των χορηγών ,των ερευνητικών κέντρων και δομών του ΕΣΥ Νοσοκομείων -ΥΠΕ, του Εθνικού Οργανισμού Φαρμάκων ,της Εθνικής Επιτροπής Δεοντολογίας και των εργαζομένων σε αυτούς τους οργανισμούς.
Αν και η προσαρμογή που απαιτείται από όλους θα είναι εκθετική και συνεχής, πιστεύω ότι ως συντελεστές του περιβάλλοντος των κλινικών δοκιμών, είμαστε πρόθυμοι να εξασφαλίσουμε την ετοιμότητα μας για την εφαρμογή του Νέου Ευρωπαϊκού Κανονισμού για τις Κλινικές Δοκιμές.
Δρ Βαρβάρα Μπαρούτσου
Εσωτερικός Παθολόγος, GFMD, EMAUD
Σύμβουλος Έρευνας & Πειραματικής Ανάπτυξης στις Ιατρικές Επιστήμες
Πρόεδρος ΕΛ.Ε.Φ.Ι.
IFAPP President Elect